Effekt-basierte Methoden
Die im Jahr 2000 in Kraft getretene Wasserrahmenrichtlinie (WRRL) hat das Ziel, dass bis 2027 alle europäischen Gewässer in einen mindestens guten ökologischen und chemischen Zustand aufweisen sollen. Weniger als 10 % der deutschen Oberflächengewässer erreichen derzeit dieses Ziel.
Welche Bedeutung Schadstoffe bei der Verfehlung dieses Ziel spielen lässt sich verhältnismäßig schwer abschätzen. Aktuell werden flächendeckend eine Auswahl an prioritären Stoffen und flussspezifischen Schadstoffen gemessen. Ein großer Nachteil klassischer chemischer Analytik ist jedoch, dass nur chemische Belastungen gefunden werden, nach denen auch gezielt gesucht wurde. Festgelegte Stoffe der analytischen Messprogramme könnten im Gewässer leicht durch andere Chemikalien mit ähnlichem Gefährdungspotential ersetzt werden. Die Abschätzung einer möglichen Belastung durch das Messen aller potentieller Schadstoffe ist in der Praxis kaum möglich. In den meisten Gewässern liegt zudem ein komplexer Cocktail an Chemikalien vor, deren Kombinationswirkungen bei rein chemischen Analysen komplett vernachlässigt wird.
Ein Lösungsansatz bieten effektbasierte Methoden zur Bewertung von Umweltbelastungen. Hierbei werden ganze Substanzgruppen mit ähnlichen Wirkmechanismen getestet, sowie Wechselwirkungen und Mischungseffekte berücksichtigt. Auffällige Substanzgruppen, können dann gezielt und kosteneffizienter mittels chemischen Analysen genauer untersucht werden. Weiterhin können effektbasierte Methoden dazu beitragen, Zusammenhänge zwischen dem chemischen und ökologischen Zustand eines Gewässers besser zu verstehen.
In-vitro-Testsysteme
Mikrotox Assay
Im Mikrotox Assay wird die Basistoxizität eine Umweltprobe getestet. Das hier verwendete Bakterium Aliivibrio fischeri besitz natürliche biolumineszente Eigenschaften. Es ist in geringen Konzentrationen in allen Weltmeeren verbreitet und lebt oft in Symbiose mit anderen Meeresbewohnern. Die Biolumineszenz beruht auf der Reaktion der Oxidation von Luciferin zu Oxyluciferin durch das Enzym Luciferase. Diese Reaktion und damit die Intensität der Lumineszenz kann z.B. durch Störung des Wachstums oder des Metabolismus durch toxische Stoffe beeinflusst werden. Zur Bewertung einer Umweltprobe wird die Lumineszenz-Inhibition des Bakteriums als nicht spezifischer Endpunkt gemessen. Dieses Verfahren beruht auf einem standardisierten Verfahren (EN ISO 11348) und wurde in Anlehnung an Escher et al (2008) für die Anwendung auf Mikrotitierplatten angepasst.
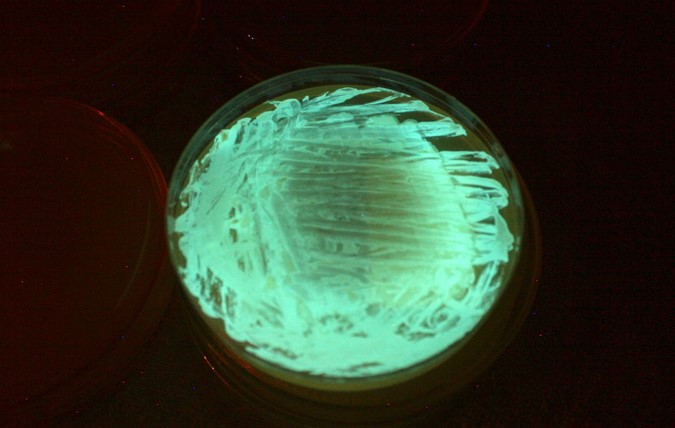
Ames Fluktuationstest
Mittels dieses Assays können mutagene Effekte in Umweltproben nachgewiesen werden. Hierbei werden genetisch veränderte Stämme von Salmonella typhimurium verwendet. Diese sind aufgrund einer Mutation im Histidinoperon nicht in der Lage die Aminosäure Histidin herzustellen. In Gegenwart von mutagenen Substanzen in der getesteten Umweltprobe steigt die Wahrscheinlichkeit einer Rückmutation. Hierbei kann die Anzahl der rückmutierten Replikate einer Probe über eine Farbreaktion nachgewiesen werden. Die Durchführung des Tests basiert auf der Guideline ISO 11350, wurde aber für die Verwendung in Mikrotitierplatten modifiziert.
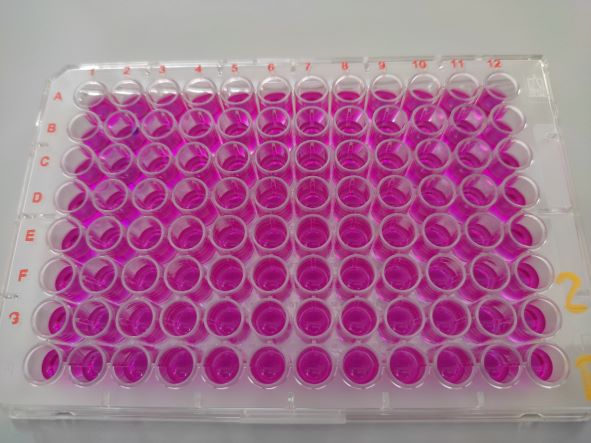
Hefereportergen Assay
Der Hefereportergen-Assay dient dem Nachweis endokriner und dioxinähnlicher Substanzen. Je nach gesuchtem Endpunkt werden dementsprechend genetisch veränderte Stämme der Bäckerhefe Saccharomyces cerevisiae verwendet, in welche humanen Hormonrezeptoreingebaut wurde. Bei Anwesenheit von östrogenen, androgenen und dioxinähnlichen Substanzen in der Probe bindet der entsprechende Agonist an den Rezeptor, was über eine Fluoreszenzmessung nachgewiesen werden kann. Bei der Testung von anti-östrogenen oder anti-androgenen wirkenden Substanzen wird eine entsprechende Antagonistische Reaktion gemessen.

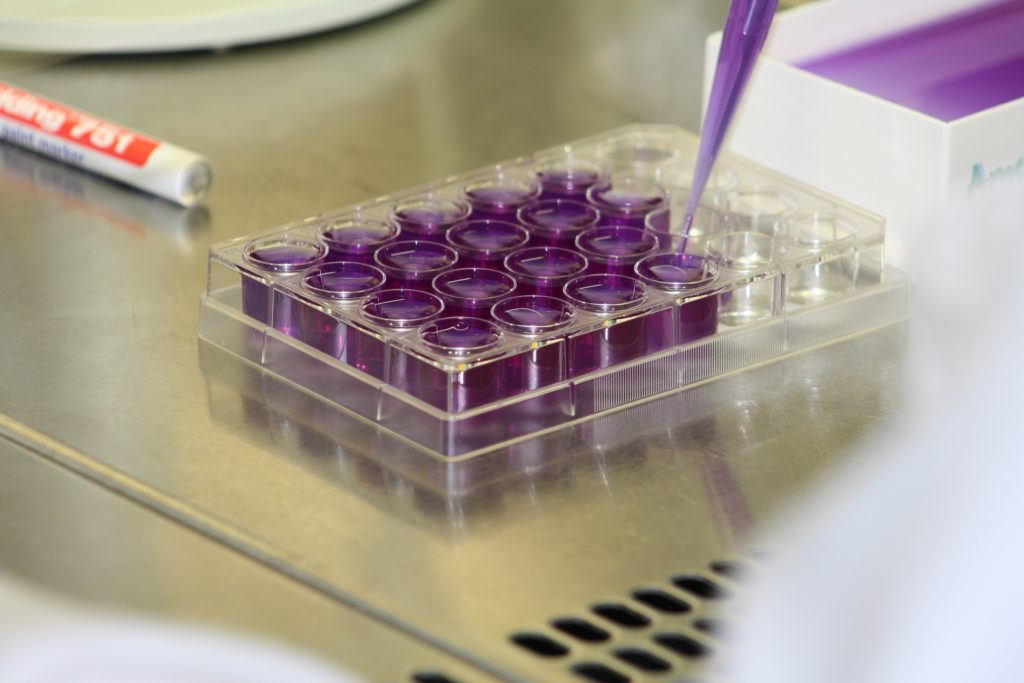
AREc32 Assay
Dieser Test dient der Bestimmung von Substanzen in einer Probe, welche oxidativen Stress oder eine Zytotoxizität in Zellen auslösen. Hierbei werden Abwehrmechanismen in der Zelle gemessen, welche bei oxidativen Stress auf zellulärer Ebene induziert werden und so die Transkription und Exprimierung von bestimmten Genen auslösen. Bei der in diesem Test verwendeten AREc32-Zell-Linie, kann eine solche Reaktion über eine Lumineszenzmessung quantitativ bestimmt werden. Weiterhin lässt sich eine mögliche Zytotoxizität von Substanzen ermitteln, indem die Stoffwechselleistung der Stellen nach Zugabe der Probe überprüft wird
In-vivo-Testsysteme
Potamopyrgus antipodarum
Durch die Sensitivität gegenüber reproduktionstoxischen Stoffen, darunter endokrinen Disruptoren (EDC), eignet sich P. antipodarum als Anzeiger für anthropogene Spurenstoffe aus Abwasser von Kläranlagen. Für die Untersuchungen wurden Schnecken mit einer Schalenlänge zwischen 3,5 bis 4,5 mm sowohl im Rahmen des aktiven Monitorings im Freiland eingesetzt, als auch parallel im Laborexperiment einem kombinierten Sediment-Wasser-System der Probestellen exponiert.


Gammarus fossarum
Der Bachflohkrebs G. fossarum zeigte sich in verschiedenen Studien als sensitiv gegenüber toxischen und endokrin wirksamen Substanzen. Zudem nehmen sie als laubzersetzende Invertebraten (Schredderer) und als Nahrungsquelle für andere aquatische Organismen eine zentrale Rolle im Nahrungsnetz ein. Um zu gewährleisten, dass nur reproduktionsfähige Tiere getestet werden, wurden Organismen mit einer Größe von mindestens 6 mm verwendet. Auch hier wurden sowohl aktive Monitorings im Freiland, als auch Laborversuche mit nativem Sediment- und Wasserproben durchgeführt.
Fisch-Ei-Test mit Danio rerio
Der Fischembryo-Toxizitätstest, kurz Fisch-Ei-Test, dient dem Nachweis embryotoxischer und teratogener Wirkungen auf den Zebrabärbling (Danio rerio). Unter teratogenen Wirkungen versteht man die Beeinträchtigung der Embryonalentwicklung durch die Einwirkung von Chemikalien. Die Verwendung dieses Organismus für Bioassays hat zahlreiche Vorteile wie eine einfache Kultivierung, hohe Reproduktionsraten und ein transparentes Chorion. Dadurch lassen sich alle wichtigen Entwicklungsstadien des Organismus und Abweichungen innerhalb dieser Stadien beobachten. Bei der Untersuchung von Wasser-/Abwasserproben, orientiert sich das Testdesign und -verfahren an der DIN EN ISO 15088.


Makrophyten
Pflanzliche Organismen erfüllen neben der Produktion von Biomasse verschiedenste Funktionen im Ökosystem Fließgewässer (z.B. Nahrung, Lebensraum, Aufnahme von Nähr- und Schadstoffe als natürliche „Filter“). Daher wurden sie als zusätzliche „Biomonitoring-Gruppe“ in diesem Projekt mit aufgenommen. Hierbei kommen die Makrophyten Lemna Gibba und Myriophyllum spicatum zum Einsatz.

Kontakt
DECIDE
Dr. Matthias Oetken
Johann Wolfgang Goethe Universität Frankfurt
Tel.: +49 (0) 69 798 42148
KONTAK
EffektMon
PD Dr. Andrea Sundermann
Senckenberg Gesellschaft für Naturforschung
Tel.: +49 (0) 6051 61954 3124
